LES ARTHROPLASTIES
PROTHETIQUES
Nous donnerons notre vision
personnelle concoctée avec le temps, partiale, peut-être subjective
sûrement et forcément évolutive. Notre spécialité est en effet une
des rares à bénéficier en temps réel, parfois un peu trop
rapidement, des progrès des biomatériaux, de la tribologie, et des
technologies numériques. Il est difficile de dire si demain nous
mettrons les mêmes prothèses qu’aujourd’hui. Cette évolutivité de
nos implants rend l’analyse clinique difficile, les problèmes après
PTH ne survenant que plusieurs années après la primo implantation.
Dans notre pratique chirurgicale, il est difficile de proposer une
étude randomisée en double aveugle, le train du progrès passant
avant que l’on ait des renseignements à long terme.
Néanmoins, il est troublant de
constater que malgré l’inflation du nombre de prothèses mises sur le
marché, les progrès significatifs depuis les travaux de Charnley et
ceux moins connus de R. Ling à Exeter, se résument à trois avancées
indiscutables :
-
Le « sans ciment » et en particulier le
revêtement des implants par de l’Hydroxyapatite (HA).
-
Les prothèses sur mesure européennes, tenant
compte de la partie endo et extra-médullaire de la hanche. Ces
prothèses par leur concept sont tout à fait différentes du « fit and
fill » américain.
-
Les nouveaux couples de friction métal-métal
(différents dans leur approche tribologique de l’ancien couple de Mc
Kee Farrar) (10,38), et ceux utilisant la céramique.
I - Planification
pré-opératoire
La mise en place d’une prothèse
totale de hanche doit débuter par une étape essentielle : le
planning pré-opératoire.
Ce planning s’appuie sur des
documents radiographiques comprenant au moins des clichés des deux
hanches de face et de profil en agrandissement à + 15% et une
télémétrie des membres inférieurs debout de face.
En cas de grande inégalité des
membres inférieurs, une analyse radiographique du rachis est
nécessaire avec et sans compensation de l’inégalité de longueur.
Des jeux de calques prothétiques
ou abaques en agrandissement à + 15% fournis par les sociétés de
matériel orthopédique sont le complément indispensable de cette
planification.
Il faut utiliser la hanche
contro-latérale comme référence si elle est saine ; cela permet de
choisir la prothèse qui se rapproche le plus de l’anatomie à la fois
endo-médullaire mais aussi extra-médullaire
Les renseignements attendus
peuvent se décomposer ainsi :
-
Taille du cotyle et hauteur d’implantation de celui-ci, centre de
rotation de la hanche prothétique.
-
Type de prothèse fémorale, angle de coupe du col fémoral et la
hauteur de l’ostéotomie cervicale.
-
Correction d’une inégalité de longueur en jouant sur la hauteur de
coupe et la longueur du col prothétique.
-
Modification de l’offset et donc de la latéralisation.
-
Epaisseur des corticales et densité osseuse. Cette étude aide au
choix ciment/sans ciment .
-
Après analyse de tous ces paramètres, la taille de la prothèse est
déterminée en s’aidant des abaques de face et de profil.
-
Enfin le calque pré-opératoire permet de prévoir une éventuelle
greffe.
II La prothèse
cotyloïdienne
Quelque soit le mode de fixation le bon positionnement de la
prothèse à 45° d’inclinaison et à 10 à 20° d’antéversion est un
facteur de prévention des luxations et de conflit entre le col
prothètique fémoral et le rebord de la cupule (impingement des
anglosaxons). Ce conflit est un facteur mécanique de descellement.
De plus, il favorise la libération de particules de polyéthyléne. Il
peut être évité grâce au bon positionnement des pièces prothètiques
et à la vérification avant fixation définitive de la prothèse
fémorale de l’absence de conflit dans les mouvements extrêmes
particulièrement en extension-adduction-rotation externe.
1° Cotyles cimentés
- La stabilité primaire est
obtenue aisément par la cimentation
- Une épaisseur de polyéthyléne
minimale de 10mm est recommandée sinon le fluage en charge sollicite
le ciment et le fragmente ce qui constitue un facteur mécanique de
descellement et un facteur biologique par réaction aux débris de
ciment.
- La stabilité secondaire est
assurée par la tenue du ciment dans l’os. Schmalzried(42)
a montré qu’entre ciment et os existait une membrane fibreuse
d’interposition favorisant la migration des débris d’usure. L’espace
effectif articulaire (Effective joint space) fait ainsi le tour de
la cupule, permet aux débris de polyéthyléne libérés par le
frottement tête-cupule de venir au contact de l’os
acétabulaire et de provoquer
l’ostéolyse périprothètique à
l’origine du descellement. Les nouvelles techniques de scellement
sous pression limitent cet espace mais ne le suppriment pas.
2° Cotyles non cimentés
Ils peuvent être pourvus d’un
filetage permettant de les visser. Ils peuvent, plus simplement,
être de forme hémisphérique comme la cavité cotyloïdienne. Ils sont
alors fixés par impaction-adaptation (« press-fit »)(9)
ou par des vis(14,22).
a)La fixation primaire
- Le
press-fit : Le press-fit assure un blocage circonférentiel de la
cupule métallique entre les parois du cotyle osseux. Il faut fraiser
le cotyle 1 ou 2 mm au dessous du diamètre de l’implant prévu. Le
fraisage doit être régulier pour réaliser une cavité hémisphérique
sans ovalisation. Pour assurer une repousse osseuse correcte, le
fond de la cupule doit être appliqué sur les parois et l’arrière
fond du cotyle.
- Le
vissage : L’utilisation de vis assure une excellente stabilité.
Toutefois, J.O. Galante,
en 1993, a signalé une possible migration des débris d’usure le long
des vis de fixation, induisant par la même une ostéolyse rapportée à
7.4% chez les sujets jeunes et donc actifs. La plupart des auteurs
se sont alors tournés vers des cotyles sans trous.
Un travail multicentrique de
Schmalzried, Brown, Amstutz, Engh et Harris
(43) a conclu sur 513 cotyles à une
ostéolyse de 15.5% pour les cotyles sans trou, 4.5% si le
cotyle avec des trous, mais sans vis, et de 2.3% si les cotyles sont
fixés avec vis.
Une étude attentive de ces
publications révèle que ces ostéolyses étaient multifactorielles :
usure accélérée du polyéthyléne en face de têtes de gros calibre
parfois en titane dont on connaît la mauvaise tenue en frottement,
épaisseur faible de polyéthyléne favorisant son fluage et la
libération de débris sur la convexité de l’insert, mobilité des
inserts dans le metal back… Nos résultats avec des prothèses à
épaisseur suffisante de polyéthyléne, bonne stabilité de l’insert et
couple de friction correct ne montrent pas de différence
significative que la cupule soit avec ou sans trous, avec ou sans
vis
b) Une épaisseur suffisante de
polyéthyléne
L’épaisseur importante du polyéthylène est essentielle. S’il est
suffisamment épais le fluage du polyéthylène se fait dans
l’épaisseur de celui ci et s’il est trop mince ce fluage retentit
sur la surface externe convexe de la cupule ce qui entraîne un
microfretting avec le métal back et éventuellement avec les trous du
métal back(fig28.).
La
norme « marquage CE » est d’exiger une épaisseur de
polyéthylène au moins égale à 6,5 mm. Nous(9)
considérons que cette épaisseur est insuffisante, elle doit être
idéalement de plus de 10 mm si l’on veut éviter des phénomènes de
fluage de la convexité de l’insert.
c) La fixation secondaire
Un traitement de la surface de la cupule au contact de l’os receveur
est indispensable si l’on veut obtenir une stabilité secondaire
durable.
Il existe deux grandes familles de traitement de surface :
-
les macro poreux permettent une repousse
osseuse à l’intérieur des macrostructures (bone ingrowth). Ces
revêtements soit madréporiques soit en fibres de titane ont
l’avantages d’une excellente stabilité secondaire mais
l’inconvénient majeur à nos yeux d’une très difficile extractibilité.
Ils posent parfois le problème de la libération dans l’articulation
des billes de chrome cobalt ou des fibres de titane.
-
Les bioactifs sont représentés
essentiellement par l’hydroxyapatite. Ce phosphate tricalcique
permet une adhérence osseuse rapide ( dans les semaines qui suivent
l’implantation), intime, sans interposition de tissu fibreux et
durable. Il s’agit d’une adhérence ( bone ongrowth) et non d’une
pénétration de l’os dans l’implant. L’éventuelle ablation de
l’implant s’en trouve facilitée.
La projection de l’hydroxyapatite
sur la surface de la prothèse répond à des exigences technologiques
très précises maîtrisées par peu de sociétés. Juste avant la
projection, la surface de l’alliage de titane est rendue rugueuse
par projection de billes de corindon plus dures que le métal qui
crée les microstructures. La résorption de l’hydroxyapatite survient
dans un délai de quelques années mais, grâce à la rugosité du
substrat sous jacent l’adhérence osseuse perdure.
II La tige fémorale
Les contraintes qui
s’appliquent sur une tige fémorale sont tout à fait différentes de
celles s’exprimant au niveau cotyloïdien(37,40,45) .
L’analyse par éléments finis
des contraintes induites par une tige sans ciment dans un fémur
montre que les forces de micro-décollement ou de micro-cisaillement
à l’interface os - prothèse sont fonction de la qualité de l’os, du
siège anatomique endo-canalaire des appuis métalliques, mais aussi
des caractéristiques extra-médullaires de la tige prothétique.
Les micromouvements et les
contraintes d’interface augmentent avec un allongement du col et une
latéralisation fémorale. Une antéversion de 15° induit une
augmentation significative de l’ordre de 35% des micro-décollements
et des micro-glissements. Une position rétroversée de même amplitude
modifie aussi mais dans un moindre degré les contraintes
d’interface . C’est dire l’importance d’un planning préopératoire et
d’une technique rigoureuse.
Prothèses cimentées
L’utilisation du ciment pour
fixer une prothèse dans le fémur est bien commode. S’il est
recommandé d’adapter la taille de la prothèse à celle du fémur(36),
il n’est pas nécessaire d’obtenir une stabilité primaire par
ajustage puisque le ciment remplit bien cet office. Les résultats à
10 à 15 ans sont corrects et c’est la raison pour laquelle certains
s’interrogent sur l’intérêt de se priver de ciment. Il a cependant
un certains nombre d’inconvénients.
-
Si les accidents cardio respiratoires à
l’injection du ciment sont rares, ils font tout de même courir un
risque de décès sur table.
-
Si l’on sait maintenant que les ostéolyses
péri-prothétiques sont principalement dues aux débris de
polyéthyléne, la réaction aux débris de ciment y participe , au même
titre que les débris de métal.
-
Les ostéolyses étendues jusqu’en pointe de
tige ne sont pas exceptionnelles, en raison de la possibilité de
migration des particules tout le long de la membrane fibreuse
d’interposition entre ciment et os.
-
Les techniques de cimentation de 2°, 3° voire
4° génération avec aspiration, lavages abondants, obturation du
canal médullaire, seringues d’injection… rendent cette chirurgie de
plus en plus complexe, longue et coûteuse.
-
Après descellement, l’ablation du ciment est
difficile et laisse un os de piètre qualité.
Pour nous l’indication d’une
prothèse cimentée est réservée aux cas où la qualité osseuse est si
précaire que la stabilité primaire d’un implant sans ciment est
compromise. Il s’agit donc d’une solution de rattrapage et non d’une
option de principe.
Prothèses non cimentées
Les premières prothèses sans
ciment ( Judet, Lord…) avaient des inconvénients : les plus connus
étaient les douleurs de cuisse et l’inextractibilité. Les douleurs
de cuisse surviennent dans deux circonstances : une instabilité ou
une fixation diaphysaire préférentielle. L’ancrage sans ciment
nécessite d’obtenir pour les tiges la même stabilité primaire que
pour les cotyles. Le blocage de la prothèse doit être recherché dans
la zone métaphysaire afin d’éviter les douleurs de cuisse induites
par des appuis distaux en diaphyse.
Il faut utiliser des méthodes
de compaction de l’os spongieux, par un design de râpes peu
agressives voire lisses, et des implants qui se bloquent au niveau
de la métaphyse fémorale en trois points. Toutefois si le spongieux
est de qualité trop médiocre, il faudra abandonner le planning sans
ciment au profit d’une tige cimentée. La technique opératoire doit
comporter des tests de stabilité qui donnent une certitude sur la
stabilité primaire dans les trois plans de l’espace : frontal,
sagittal et rotatoire. Les prothèses revêtues d’hydroxyapatite
qu’elles soient droites ou courbes permettent une fixation métaphyso
diaphysaire lorsque le revêtement est sur toute la longueur de la
prothèse et métaphysaire pure quand il est limité à la moitié
supérieure. Ces dernières ont le considérable avantage à nos yeux
d’être extirpables sans réaliser d’importants dégâts osseux.
Les prothèses sans ciment ont
deux inconvénients : la technique opératoire nécessite un
apprentissage et le prix de la prothèse est supérieur à celui des
prothèses cimentées. En l’absence de ciment, il faut apprendre à
adapter parfaitement la prothèse au fémur et à obtenir une stabilité
primaire certaine. Lors ce que cette technique est acquise, la mise
en place de la prothèse sans ciment est plus simple et plus rapide
que pour une prothèse cimentée. Si les prothèses sans ciment sont
plus chères que les cimentées, plusieurs travaux(2) ont
conclu à un moindre coût global pour les sans ciment : pas
besoin des accessoires nécessités par les cimentation modernes, gain
de temps…
Dernier avantage et non des
moindres : la prévention des ostéolyses diaphysaires. Le traitement
de surface hydroxyapatite circonférentiel en métaphyse s’oppose à la
migration des particules de polyéthyléne car il n’y a pas de tissu
fibreux entre hydroxyapatite et os. Cette absence d’ostéolyse
étendue fémorale vérifiée dans toutes les séries à plus de 10 ans
représente un avantage décisif.
Prothèses sur mesure
Les fémurs très remaniés soit
par des causes acquises ou le plus souvent congénitales ne sont pas
en règle accessibles à des interventions classiques surtout si le
fémur est étroit et très antéversé. Il faut alors se tourner vers
des implants sans ciment sur mesure qui seront les garants d’une
bonne adaptation de l’implant et permettront de régler les problèmes
de dysmorphie extra-médullaire.
III Les couples de
friction
La
« low friction » de Charnley est une réalité vérifiée
chaque jour. Les meilleurs résultats à plus de 10 ans avec les 22,2
mmm qu’avec les 32mm ne sont plus contestés(46). Les
têtes 28mm sont, pour certains un bon compromis entre les 22mm qui
se luxeraient plus et les 32mm. Un fait incontestable est que
le volume de débris dépend du volume de la tête :
V =
P R 2 U
V = volume de débris R = le rayon de la tête
U= usure linéaire
Le volume de débris est
proportionnel au carré du rayon. Cependant la low friction n’est pas
la panacée et pour supprimer les débris d’usure du polyéthyléne, il
faut remplacer le polyéthyléne.
Le
métal-métal
Le couple « métal-métal » dit
de deuxième génération est actuellement publié avec plus de 12 ans
de recul(10). Nous n’en avons pas l’expérience. Plus de
100.000 implantations de Metasul ont été réalisées à ce jour sans
problème apparent. Le comportement de ce couple de friction n’a pas
montré de différence entre le modèle expérimental et les résultats
« in vivo ». Ces résultats encourageants ne doivent pas faire perdre
de vue que la libération à long terme de particules métalliques,
particulièrement de chrome non éliminées donc stockées dans
l’organisme fait courir le risque d’une toxicité locale ou générale.
C’est la raison pour laquelle nous nous sommes tournés vers l’alumine-alumine.
Les
couples céramique-céramique
Les accidents récents survenus
au cours de l’utilisation de têtes en zircone met la zircone, au
moins temporairement, au second plan. L’alumine est très largement
utilisée. L’avantage du couple alumine-alumine est de ne présenter
qu’une usure minime (Prudhommeaux).
(35) Le deuxième avantage est que les très faibles
quantités de débris d’alumine sont bien tolérées par l’organisme.
L’inconvénient des céramiques est qu’il existe des risques réels de
fracture des implants. Sans vouloir rentrer dans un débat trop
technique, un certain nombre de critères sont fondamentaux afin de
garantir une solidité de la céramique
-
Pureté des poudres utilisées.
-
Densité aussi proche que possible de la
densité théorique.
-
Taille des grains inférieure à 0.6 µm.
-
Compaction en pression isostatique (sup à
1000 bars).
-
Porosité la plus réduite possible, elle est
fonction de la taille des grains et du procédé de fabrication.
-
Contrôles rigoureux d’usinage en recherchant
des défauts de sphéricité et des microruptures qui élimineront la
céramique du circuit.
-
Test de résistance à 100%...
C’est dire que la qualité d’un
implant en céramique dépend intimement du soin extrême apporté à la
fabrication et au contrôle de tous les maillons de la chaîne jusqu’à
l’intervention. Les implants en céramique modernes comportent un
risque de rupture très faible de l’ordre de 1/10 000 à 1/100 000
selon les statistiques (Cameron) (5) . Les avantages
sont plus importants que les inconvénients. Ce risque très faible de
rupture est conditionné par une utilisation adéquate des implants
par le chirurgien. Il faut manipuler les têtes et les inserts avec
précautions, éviter de les frapper lors de leur mise en place. Le
risque de fracture augmente en cas de malpositions : verticalisation
du cotyle, antéversion excessive, conflit entre le rebord de la
cupule et le col, instabilité … Ce couple doit être réservé à
des opérateurs confirmés avec une courbe d’apprentissage virtuelle ;
la sélection des patients se doit draconienne afin d’éviter des
impacts en décoaptation, l’utilisation chez des patients obèses doit
être évaluée avec soin.
IV Le choix final de
la prothèse
1) Prothèse cimentée au niveau fémoral
et cotyle sans ciment dite hybride
Pour nous l’indication d’une
prothèse fémorale cimentée naît des contre-indications des prothèses
sans ciment : corticales fémorales fines avec difficulté d’obtenir
une stabilité primaire sans ciment. La tige est une tige droite en
inox(fig. 29) .
Un fémur en tuyau de poêle dont
l’indice de Noble est inférieur à 2.7 est plus confortablement opéré
avec une tige cimentée, une prothèse sans ciment ne pouvant dans ce
cas de figure que trouver des appuis diaphysaires avec un risque de
descente de la tige et donc de douleurs de cuisse .
2)
Les prothèses sans ciment
Si la qualité du spongieux et
des corticales est correcte, trois types de prothèses peuvent être
posés en fonction de la planification pré-opératoire en se basant
essentiellement sur l’étude extra-médullaire et l’indice de Noble.
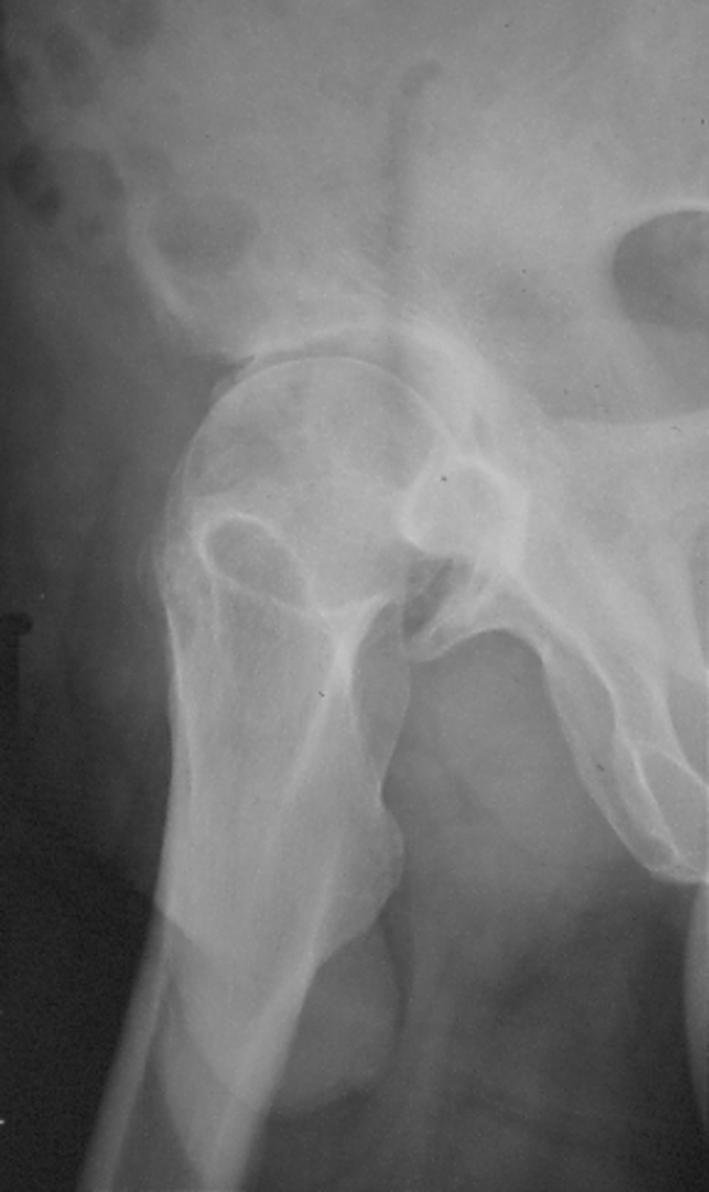
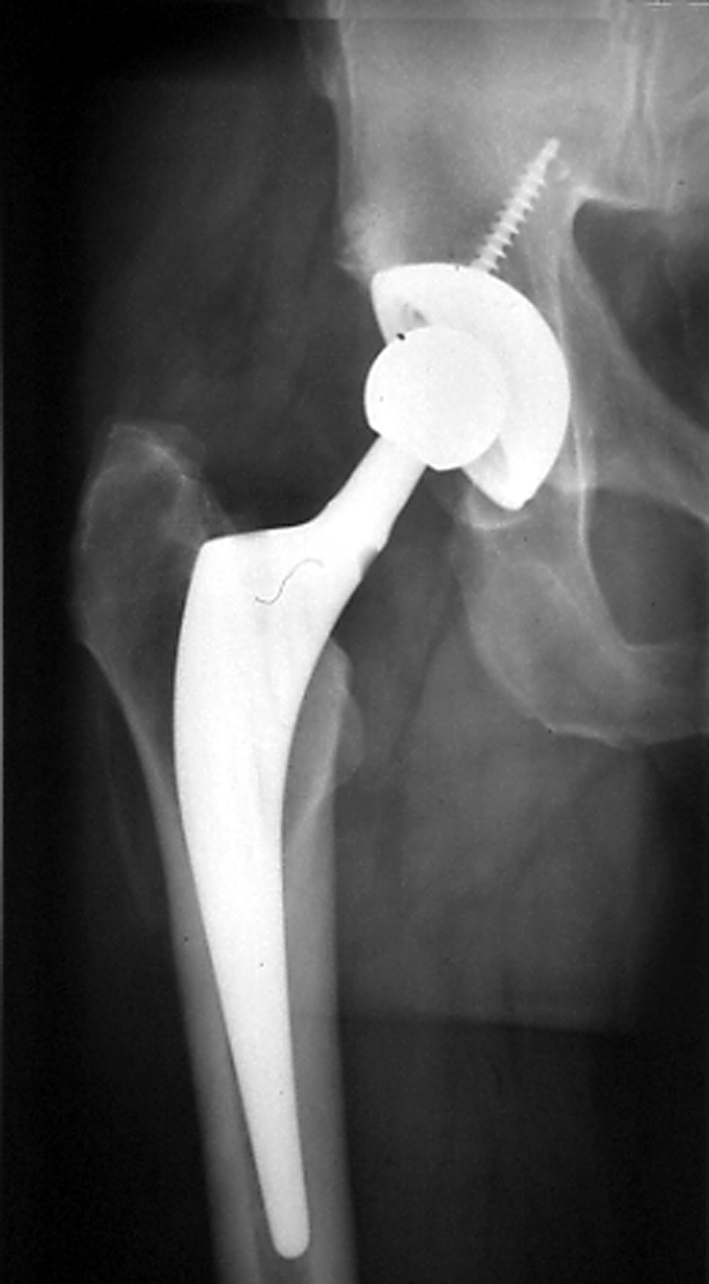
Tige droite.
Si l’angle cervico-diaphysaire
est normal ou en valgus et/ou indice de Noble compris entre 3 et 5,
une tige droite peut être utilisée(fig.30).
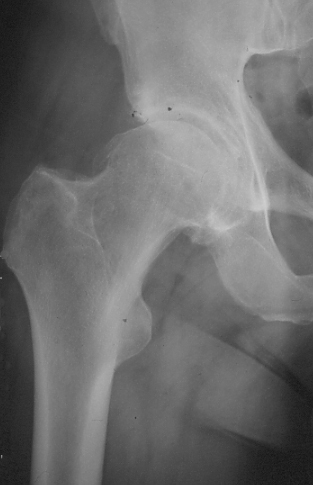 |
 |
 |
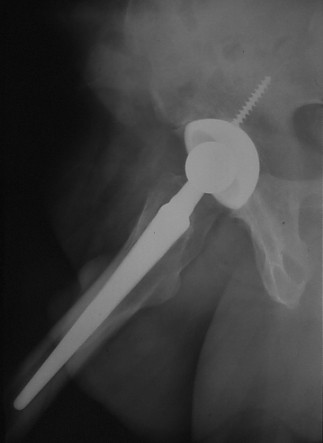 |
| Figure 30 : Tige droite sans
ciment |
|
|
|
En cas de col en varus ou à
tendance varisante, indice de Noble >5, on peut préférer une tige
anatomique avec une hélitorsion marquée car ces hanches ont des
morphotypes cotyloidiens retroversés( fig. 31 et 32).
La
tige doit être très bien centrée dans le fémur, posée en axial
strict, l’antéversion étant donnée par l’hélitorsion de la
prothèse ; ces prothèses sont bien entendu « droite / gauche ».
Tige modulaire
On peut aussi utiliser des
prothèses modulaires qui permettent d’adapter la forme de la
prothèse à la forme du fémur (fig. 33).
3° Les prothèses
sur mesure
Le coût d’un tel implant
interdit la pose chez tout un chacun. Il est illogique chez un
patient trop âgé, trop peu demandeur d’activité ou à faible
espérance de vie. En ce qui concerne les dysmorphies fémorales, le
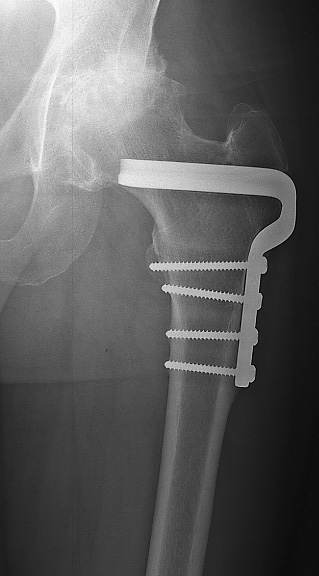
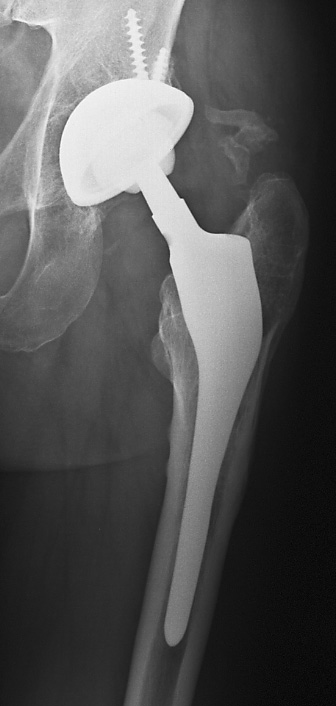
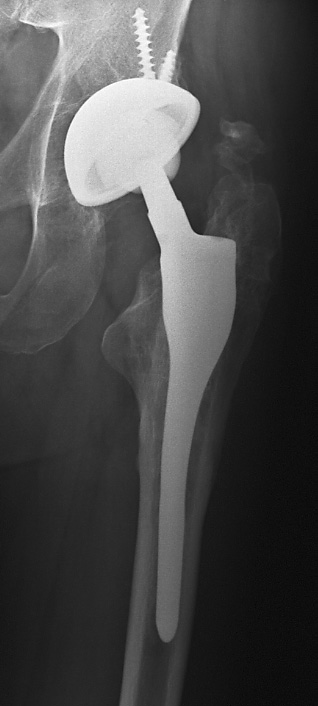
choix d’une prothèse sur mesure n’est plus contesté(fig.34).
 |
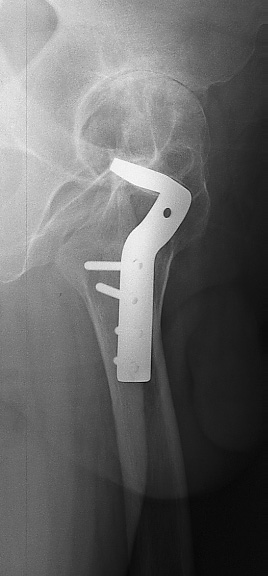 |
Figure 34 : Dysmorphie fémorale
proximale après ostéotomie. Mise en place dune PTH sur mesure |
 |
 |
|
CONCLUSION
Les améliorations constantes de
la fiabilité des prothèses de hanche et la qualité de vie qu’elles
procurent aux patients marginalisent de plus en plus les ostéotomies
« autour de la hanche ».
Le contexte juridique n’est pas
non plus favorable au développement de techniques conservatrices qui
sont toutes grevées d’une morbidité plus importante que les PTH.
Elles ne survivent réellement que de la correction des dysplasies
fémorales et cotyloïdiennes de bas grade.
La réglementation en vigueur,
l’homologation des prothèses puis le marquage CE, la
matériovigilance contribuent à garantir au patient la qualité des
prothèses. Un suivi clinique de meilleure qualité des implants grâce
à un Registre français des PTH contribuerait à terme à prouver
de façon rationnelle et incontestable quelles seront les options à
prendre ou à conserver dans l’avenir. Cela permettrait à la
communauté orthopédique française de maîtriser la connaissance
et d’éviter de se voir imposer des standards par une Administration
très sensibilisée aux économies à court terme mais peu consciente
des enjeux à long terme.
BIBLIOGRAPHIE
1 Aubaniac J.M, Argenson
J.N, Gravier R. – L’ostéotomie périacétabulaire de Ganz dans le
traitement de la coxarthrose. In : Progrès en médecine physique et
de réadaptation. Pp 89-98.Masson Edit.
2
Barrack RL, Castro F, Guinn S: Cost of implanting a cemented versus
cementless femoral stem. J.Arthoplasty, 1996,11,373-376.
3
Bombelli R. – Osteoarthritis of the hip. Pathogenis and consequent
therapy. Berlin-Heidelberg-New York. Springer
Verlag Edit. 1976.
4
Callaghan J.J, Forest E.E, Sporer S.M, Goetz D.D, Johnston R.C. –
Total hip arthroplasty in the young adult. Clin. Orthop.,
1997, 344, 257-262.
5
Cameron H. Structural Ceramics in Orthopaedics. In : Bone Implant
Interface St Louis MO, Mosby, 1994 pp 203.
6 Chiari K, Endler M,
Hackel H. – Indications et résultats de l’ostéotomie du bassin selon
Chiari dans les arthroses avancées. Acta Orthop. Belg., 1978, 44,
176-187.
7 Chiron P, Giordano G,
Tricoire J.L. – Technique de la butée de hanche percutanée.
Rev. Chir. Orthop., 1999, 85, 102-103.
8
Crowe J.F, Mani V.J, Ranawat C.S. – Total hip replacement in
congenital dislocation and dysplasia of the hip. J.Bone Joint
Surg., 1979 ; 61A : 15-23.
9 Dambreville A,
Lautridou P. – Les cotyles impactés. Eur. J.
Orthop. Surg. Traumatol., 1996, 6, 217- 222.
10 Delaunay C. – Couple
de friction de seconde génération en arthroplastie totale
primaire non cimentée de hanche. Rev. Chir.
Orthop., 2000, 86, 809-824.
11 Dujardin F,
Aucouturier T, Bocquet G, Duparc F, Weber J, ThomineJ.M. –
Cinématique de la coxo-fémorale saine et arthrosique durant la
marche. Etude de 136 sujets. Rev. Chir. Orthop.,
1998, 84, 689-699.
12
Ganz R, Klaue K, Vihn T.S, Mast J. – A new periacetabular osteotomy
for the treatment of hip dysplasias. Clin. Orthop., 1988, 232,
26-36.
13
Harris W.H : Traumatic arthtitis of the hip after dislocation and
acetabular fractures : treatment by mold arthroplasty. An end-result
study using a new method of result evaluation. J.Bone Joint Surg.,
1969,51A,4,737-755.
14
Harris W.H: The lessons of acetabular component fixation.
Orthopedics, 1995, 18, 811-812.
15
Hiranuma S, Higuchi F, Inoue A, Miyazaki M. – Changes in the
interposed capsule after. Chiari osteotomy. J. Bone Joint
Surg., 1992, 74B, 463-467.
16 Hulet C, Schiltz,
Vielpeau C, Locker B, Richter D, Aubriot J.H. – Incidence de
l’arthrose dans les résultats du traitement de la coxarthrose de
l’adulte jeune par ostéotomie de Chiari. Etude rétrospective de 52
hanches avec 10.5 ans de recul moyen. Rev. Chir.
Orthop., 1998, 84, 41-50.
17 Hulet C, Hurwitz D.E,
Andriacchi T.P, Galante J.O, Vielpeau C. – Mécanismes d’adaptation
fonctionnelle de la marche à une douleur invalidante de la
coxo-fémorale. Rev. Chir. Orthop.
2000, 86, 581-589.
18
Husmann O, Rubin P.J, Leyvraz P.F, De Roguin B, Argenson J.N. –
Three-dimensional morphology of the proximal femur. J. Arthroplasty.,
1997, 12, 4.
19 Journeau P, Mabesoone
F, Touzet Ph, Prieur A.M, Rigault P.- Arthroplastie totale de hanche
dans l’arthrite chronique juvénile. Revue d’une série de 34
prothèses. Rev. Chir. Orthop., 1996, 82, 508-521.
20 Kerboull M.- Les
indications thérapeutiques générales de la luxation congénitale de
l’adulte. Acta Orthop. Belg., 1990, 56, 407-413.
21 Langlais F, Lambotte
j.C. – Ostéotomies de l’extrémité supérieure du fémur. Encycl. Med.
Chir., Techniques chirurgicales – Orthopédie-Traumatologie, 1999,
44-654, 16p.
22 Lecoq C, Rochwerger
A, Curvale G, Groulier P.- Complications liées à l’utilisation de la
cupule de Harris- Galante de première génération au recul moyen de 7
ans. Rev. Chir. Orthop., 1999, 85, 689-697.
23
Lequesne M, Mery C, Samson M, Gerard P. - Indexes of severity for
osteoarthritis of the hip and knee. Scand. J. Rheumatol., 1987; 65 :
85-9.
24 Lequesne M, Lemoine
A, Hassafe C. - Le complet radiologique coxo-fémoral. Dépistage et
bilan préopératoire des vices architecturaux de la hanche.
J. Radiologie., 1964, 45, 27-44.
25
Lequesne M, MENKES CJ Atlas de l’arthrose NEGMA 1995
26
Leunig M, Siebenrock K.A, Mahomed M.N, Ganz R. – Bernese
periacetabular osteotomy: technical aspects and clinical results.
Hip International, 1999, 9, 119-126.
27 Manuceau J.- Modèle à
trois dimensions de l’articulation de la hanche.
Rev. Chir. Orthop., 1991, 77, 293-300.
28
Maquet P. - Biomechanics of the hip as applied to osteoarthritis and
related conditions. Berlin-Heidelberg-NewYork,
Springer Verlag Edit., 1985.
29
Maquet P.- Biomechanics of hip dysplasia. Acta Orthop. Belg.,
1999, 65, 302-314.
30 Merle d’Aubigné R.-
Cotation chiffrée de la fonction de la hanche.
Rev. Chir. Orthop., 1970, 56, 481-486.
31 Mourgues de G, Patte
D., - Résultats après au moins 10 ans d’ostéotomies d’orientation du
col du fémur dans les coxarthroses secondaires peu évoluées de
l’adulte. Rev . Chir. Orthop., 1978, 64, 527.
32
Noble P.C, Alexander J.W, Lindahl L.J, et al. – The anatomic basis
of femoral component design. Clin. Orthop.,1988; 235,
148-165.
33 Pauwels F. -
Biomécanique de la hanche saine et pathologique.
Berlin-Heidelberg-NewYork, Springer Verlag Edit., 1977.
34 Pidhorz L, Sedel L. –
Les prothèses de hanche avant 50 ans. Rev. Chir.
Orthop., 1998, 84 (suppl 1), 75-120.
35
Prudhommeaux F, Hamadouche M, Nevelos J, Doyle C, Meunier A and
Sedel L. Near ef alumina on alumina total hip arthroplasties at a
mean II year followup. Clin Orthop 379 : 113-122, 2000
36
Ramaniraka N.A, Rakotomanana L.R, Leyvraz P.F. –The fixation of
cemented femoral component : Effects of the stem stiffness, cement
thickness, and cement-bone rugosity. J. Bone Joint Surg.,
2000, 82B, 297-303.
37 Ramaniraka N.A,
Rakotomanana L.R, Rubin P.J, Leyvraz P.F.- Arthroplastie totale non
cimentée de la hanche : influence des paramètres extra-médullaires
sur la stabilité primaire de l’implant et sur les contraintes à
l’interface os-implant. Rev. Chir. Orthop., 2000,
86, 590- 597.
38 Ray A. – Survie à
plus de 15 ans de prothèses métal-métal de Mac-Kee Farrar. A propos
de 58 observations et de 4 cupules explantées.
Rev. Chir. Orthop., 1996, 82, 85-89.
39
Rubin P.J, Leyvraz P.F, Aubaniac J.M, Argenson J.N, Esteve P, De
Roguin B. The morphology of the proximal
femur. A three-dimensional radiographic analysis. J.Bone
Joint Surg., 1992 ; 74B : 28-32.
40 Rubin P.J, Rakotomana
R.L, Leyvraz P.F, Zysset P.K, Curnier A, Heegaard.
Frictional interface micromotions and anisotropic
stress distribution in a femoral total hip component. J.Biomechanics,
1993, 26, 725-739.
41
Rydell N. - Biomechanics of the hip joint . Clin. Orthop., 1973, 92,
6-15.
42
Schmalzried T.P., Jasty M., Harris W.H. : Periprosthetic bone loss
in total hip arthroplasty : polyethylene wear and the concept of
effective joint space. J.Bone Joint Surg. 1992, 74A, 849-863
43
Schmalzried T.P, Brown IC Amstutz HC; Engh CA, Harris WH. The role
of acetabular component screw hales and/or screw in the development
of pelvic osteolysis proc inst mech eng CH 1999 ; 213 (2) 147-153
44 Vidalain J.P.- Les
prothèses de hanche avant 50 ans. Symposium SOFCOT. Résultats des
tiges. Rev. Chir. Orthop., 1998, 84 Supp1,
115-118.
45
Walker P.S., Schneeweis D, Murphy S, Nelson P.- Strains and
micromotion of press-fit femoral stem prostheses. J. Biomech., 1987,
20, 693-702.
46
Wroblewsky B.M, Taylor G.W, Simey P. – Charnley low-friction
arthroplasty : 19 to 25 Years results. Orthopaedics, 1992, 15,
421-424.
Revenir en Haut
Page 1
|